WikiDer > Seriy (III) xlorid
 | |||
| Ismlar | |||
|---|---|---|---|
| IUPAC nomlari Seriy (III) xlorid Terixlorid seriy | |||
| Boshqa ismlar Cerous xlorid | |||
| Identifikatorlar | |||
| |||
3D model (JSmol) | |||
| ChEBI | |||
| ChemSpider | |||
| ECHA ma'lumot kartasi | 100.029.298 | ||
| EC raqami |
| ||
| 1828 | |||
PubChem CID | |||
| UNII | |||
CompTox boshqaruv paneli (EPA) | |||
| |||
| |||
| Xususiyatlari | |||
| CeCl3 | |||
| Molyar massa | 246,48 g / mol (suvsiz) 372,58 g / mol (geptahidrat) | ||
| Tashqi ko'rinish | mayda oq kukun | ||
| Zichlik | 3.97 g / sm3 | ||
| Erish nuqtasi | 817 ° C (1,503 ° F; 1,090 K) (suvsiz) 90 ° C (geptahidrat, parchalanadi) | ||
| Qaynatish nuqtasi | 1,727 ° C (3,141 ° F; 2000 K) | ||
| 100 g / 100 ml | |||
| Eriydiganlik | ichida eriydi spirtli ichimliklar | ||
| +2490.0·10−6 sm3/ mol | |||
| Tuzilishi | |||
| olti burchakli (UCl3 turi), hP8 | |||
| P63/ m, № 176 | |||
| Uchburchak prizmatik (to'qqiz koordinatali) | |||
| Xavf | |||
| GHS piktogrammalari |    | ||
| GHS signal so'zi | Xavfli | ||
| H315, H318, H319, H335, H400, H410 | |||
| P261, P264, P271, P273, P280, P302 + 352, P304 + 340, P305 + 351 + 338, P310, P312, P321, P332 + 313, P337 + 313, P362, P391, P403 + 233, P405, P501 | |||
| o't olish nuqtasi | Yonuvchan emas | ||
| Tegishli birikmalar | |||
Boshqalar anionlar | Seriy (III) oksidi Seriy (III) ftor Seriy (III) bromidi Seriy (III) yodid | ||
Boshqalar kationlar | Lantan (III) xlorid Praseodimiy (III) xlorid | ||
Boshqacha ko'rsatilmagan hollar bundan mustasno, ulardagi materiallar uchun ma'lumotlar berilgan standart holat (25 ° C [77 ° F], 100 kPa da). | |||
| Infobox ma'lumotnomalari | |||
Seriy (III) xlorid (CeCl3) seroz xlorid yoki seriy triklorid deb ham ataladi, bu birikma seriy va xlor. Bu oq gigroskopik tuz; a hosil qilish uchun nam havo ta'sirida suvni tez yutadi hidrato'zgaruvchan tarkibga o'xshaydi,[1] heptahidrat CeCl bo'lsa ham3· 7H2O ma'lum. Bu juda yaxshi eriydi suv, va (suvsiz bo'lganda) u eriydi etanol va aseton.[2]
Suvsiz CeCl tayyorlash3
Faqatgina gidratning tez tez qizishi oz miqdordagi sabab bo'lishi mumkin gidroliz.[3]
Suvsiz CeCl ning foydali shakli3 vakuum ostida geptahidratni ko'p vaqt davomida 140 ° C (284 ° F) ga qadar qizdirishga ehtiyotkorlik bilan qaralsa, tayyorlanishi mumkin.[2][4][5] Bunda ozgina CeOCl bo'lishi mumkin yoki bo'lmasligi mumkin gidroliz, lekin u bilan ishlatish uchun javob beradi organolitiy va Grignard reaktivlari. Sof suvsiz CeCl3 gidratni dehidratatsiya qilish yo'li bilan yoki 4-6 ekvivalent bilan asta-sekin 400 ° C (752 ° F) ga qadar qizdirish orqali amalga oshirilishi mumkin. ammoniy xlorid yuqori vakuum ostida,[3][6][7][8] yoki ortiqcha bilan isitish orqali tionil xlorid uch soat davomida.[3][9] Suvsiz haloid muqobil ravishda tayyorlanishi mumkin seriy metall va vodorod xlorid.[10][11] Odatda yuqori vakuum ostida yuqori haroratli sublimatsiya bilan tozalanadi.
Foydalanadi
'Serum (III) xlorid' boshqasini tayyorlash uchun boshlang'ich nuqtasi sifatida ishlatilishi mumkin seriy tuzlarkabi Lyuis kislotasi, seriy (III) triflorometansülfonatuchun ishlatilgan Fridel-hunarmandchilik asilatsiyalar. Shuningdek, u o'zi sifatida ishlatiladi Lyuis kislotasi, masalan, Fridel-Kraftda katalizator sifatida alkillanish reaktsiyalar.[12]
Luche kamayishi[13] alfa, beta-to'yinmagan karbonil birikmalarining mashhur usuli bo'ldi organik sintez, bu erda CeCl3· 7H2O bilan birgalikda ishlatiladi natriy borohidrid. Masalan, karvon faqat allilni beradi spirtli ichimliklar 1 va hech biri to'yingan spirtli ichimliklar 2. CeCl holda3, aralashmasi 1 va 2 hosil bo'ladi.
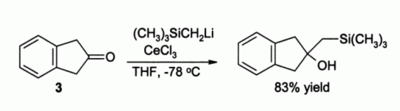
Ichida yana bir muhim foydalanish organik sintez ning alkilatsiyasi uchundir ketonlar, aks holda shakllanishi mumkin enolates oddiy bo'lsa organolitiy reaktivlari ishlatilishi kerak edi. Masalan, birikma 3 oddiygina CeCl holda enolat hosil qilishi kutilgan bo'lar edi3 mavjud, ammo CeCl ishtirokida3 silliq alkillanish paydo bo'ladi:[4]
Ma'lum qilinishicha, organolitiy reaktivlari ushbu reaktsiyada samaraliroq ishlaydi Grignard reaktivlari.[4]
Adabiyotlar
- ^ Alfa va Strem kabi bir qancha buyuk ishlab chiqaruvchilar o'z mahsulotlarini shunchaki "hidrat" sifatida "xH2Formulada O ", ammo Aldrich geptahidrat sotadi.
- ^ a b Paket, L. A. (1999). Kates, R. M .; Daniya, S. E. (tahrir). Organik sintez uchun reaktivlar bo'yicha qo'llanma: reaktivlar, yordamchi moddalar va C-C obligatsiyasini hosil qilish uchun katalizatorlar.. Nyu-York: Vili. ISBN 0-471-97924-4.
- ^ a b v Edelmann, F. T .; Poremba, P. (1997). Herrmann, W. A. (tahrir). Organometalik va anorganik kimyoning sintetik usullari. VI. Shtutgart: Georg Thieme Verlag. ISBN 3-13-103021-6.
- ^ a b v Jonson, C. R .; Tait, B. D. (1987). "Peterson reaktsiyasining seriy (III) modifikatsiyasi: osonlik bilan enolizatsiyalanadigan karbonil birikmalarining metilenlanishi". Organik kimyo jurnali. 52 (2): 281–283. doi:10.1021 / jo00378a024. ISSN 0022-3263.
- ^ Dimitrov, Vladimir; Kostova, Kalina; Genov, Miroslav (1996). "Suvsiz seriy (III) xlorid - quritish jarayonining faollik va samaradorlikka ta'siri". Tetraedr xatlari. 37 (37): 6787–6790. doi:10.1016 / S0040-4039 (96) 01479-7.
- ^ Teylor, M. D .; Carter, P. C. (1962). "Suvsiz lantanidli galogenidlarni, ayniqsa yodidlarni tayyorlash". Anorganik va yadro kimyosi jurnali. 24 (4): 387–391. doi:10.1016/0022-1902(62)80034-7.
- ^ Kutscher, J .; Shnayder, A. (1971). "Notiz zur Präparation von wasserfreien Lanthaniden-Haloge-niden, Insbesondere von Jodiden". Inorg. Yadro. Kimyoviy. Lett. 7 (9): 815. doi:10.1016/0020-1650(71)80253-2.
- ^ Grinvud, N. N .; Earnshaw, A. (1984). Elementlar kimyosi. Nyu-York: Pergamon Press. ISBN 0-08-022056-8.
- ^ Friman, J. X .; Smit, M. L. (1958). "Tionil xlorid bilan suvsizlantirish orqali suvsiz anorganik xloridlarni tayyorlash". Anorganik va yadro kimyosi jurnali. 7 (3): 224–227. doi:10.1016/0022-1902(58)80073-1.
- ^ Druding, L. F .; Corbett, J. D. (1961). "Lantanidlarning quyi oksidlanish darajasi. Neodimiy (II) xlorid va yodid". Amerika Kimyo Jamiyati jurnali. 83 (11): 2462–2467. doi:10.1021 / ja01472a010. ISSN 0002-7863.
- ^ Corbett, J. D. (1973). "Nodir Yer elementlarining kamaytirilgan galogenidlari". Vahiy Chim. Minerale. 10: 239.
- ^ Meniki, Norioki; Fujivara, Yuzo; Taniguchi, Xiroshi (1986). "Triklorolantanoid (LnCl.)3) - katalizlangan Fridel-Kraft alkillanish reaktsiyalari ". Kimyo xatlari. 15 (3): 357–360. doi:10.1246 / cl.1986.357.
- ^ Luche, Jan-Lui; Rodriges-Xann, Lidiya; Crabbé, Per (1978). "Terixlorid seriy ishtirokida tabiiy enonlarning kamayishi". Kimyoviy jamiyat jurnali, kimyoviy aloqa (14): 601–602. doi:10.1039 / C39780000601.
Qo'shimcha o'qish
- CRC Kimyo va fizika bo'yicha qo'llanma (58-nashr), CRC Press, West Palm Beach, Florida, 1977 yil.
- Anvander, R. (1999). Kobayashi, S. (tahrir). Lantanidlar: kimyo va organik sintezda foydalanish. Berlin: Springer-Verlag. pp.10–12.