WikiDer > Ftorobenzol
| Ismlar | |||
|---|---|---|---|
| IUPAC nomi Ftorobenzol | |||
| Boshqa ismlar Fenil ftorid Monoflorobenzol | |||
| Identifikatorlar | |||
3D model (JSmol) | |||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| ECHA ma'lumot kartasi | 100.006.657 | ||
| KEGG | |||
PubChem CID | |||
| UNII | |||
CompTox boshqaruv paneli (EPA) | |||
| |||
| |||
| Xususiyatlari | |||
| C6H5F | |||
| Molyar massa | 96.103 | ||
| Tashqi ko'rinish | Rangsiz suyuqlik | ||
| Zichlik | 1,025 g / ml, suyuqlik | ||
| Erish nuqtasi | -44 ° C (-47 ° F; 229 K) | ||
| Qaynatish nuqtasi | 84 dan 85 ° C gacha (183 dan 185 ° F; 357 dan 358 K gacha) | ||
| past | |||
| -58.4·10−6 sm3/ mol | |||
| Tuzilishi | |||
| Planar | |||
| Xavf | |||
| R-iboralar (eskirgan) | R36, R37, R38 | ||
| S-iboralar (eskirgan) | S16, S26, S36 | ||
| NFPA 704 (olov olmos) | |||
| Tegishli birikmalar | |||
Tegishli halobenzenlar | Xlorobenzol Bromobenzol Iodobenzol | ||
Tegishli birikmalar | Benzol 1,2-Diflorobenzol | ||
Boshqacha ko'rsatilmagan hollar bundan mustasno, ulardagi materiallar uchun ma'lumotlar berilgan standart holat (25 ° C [77 ° F], 100 kPa da). | |||
| Infobox ma'lumotnomalari | |||
Ftorobenzol bo'ladi kimyoviy birikma C formulasi bilan6H5F, ko'pincha qisqartiriladi DoktorF. rangsiz suyuqlik, u ko'plab florofenil birikmalarining kashfiyotchisi hisoblanadi.
Tayyorgarlik
PhF haqida birinchi marta 1886 yilda O. Valach tomonidan Bonn universiteti, aralashmani ikki bosqichda tayyorlagan. Fenildiyazonyum xlorid birinchi marta a ga aylantirildi triazen piperidin yordamida:
- [PhN2] Cl + 2 (CH2)5NH → PhN = N-N (CH2)5 + [(CH2)5NH2] Cl
Keyin triazin bilan yopishtirildi gidroflorik kislota:
- PhN = N-N (CH2)5 + 2 HF → PhF + N2 + [(CH2)5NH2] F
Tarixiy eslatma: Uolax davrida ftor elementi "Fl" bilan ramziy qilingan. Shunday qilib, uning protsedurasi “Fluorbenzol, C6H5Fl ”.[1]
Laboratoriya miqyosida PhF tomonidan tayyorlanadi termal parchalanish ning benzenediazonium tetrafloroborat:
- PhN2BF4 → PhF + BF3 + N2
Jarayonga muvofiq, qattiq [PhN2] BF4 boshlash uchun olov bilan isitiladi ekzotermik reaktsiya, bu ham beradi bor triflorid va azotli gaz. Mahsulot PhF va BF3 turlicha bo'lganligi sababli osongina ajralib turadi qaynash nuqtalari.[2]
Texnik sintez reaktsiyasi bilan amalga oshiriladi siklopentadien bilan diflorokarben. Dastlab shakllangan siklopropan halqaning kengayishi va keyinchalik yo'q qilinishiga olib keladi ftorli vodorod.
Reaksiyalar
PhF floridning pi-donorlik xususiyatlari tufayli boshqa halobenzol hosilalaridan ancha farq qiladi. Masalan, elektrofillarga nisbatan benzolga qaraganda para holati faolroq. Shu sababli uni nisbatan yuqori samaradorlikka ega 1-bromo-4-florobenzolga aylantirish mumkin.[3]
Hal qiluvchi xossalari
PhF yuqori reaktiv turlar uchun foydali erituvchidir. Uning -44 ° C darajadagi erish nuqtasi benzolnikidan pastroq. Aksincha, PhF va benzolning qaynash nuqtalari juda o'xshash, ular atigi 4 ° C bilan farqlanadi. U benzolga qaraganda ancha qutbli, dielektrik doimiyligi 5,42, 298 K gacha bo'lgan benzol uchun 2,28.[4] Ftorobenzol - bu C-F bog'lanish kuchini aks ettiruvchi nisbatan inert birikma.
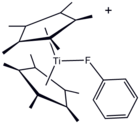
Odatda u koordinatsion bo'lmagan erituvchi deb hisoblansa-da, PhF ning metall kompleksi kristallangan.[5]
Shuningdek qarang
Adabiyotlar
- ^ Wallach, O. “Über einen Weg zur leichten Gewinnung organischer Fluorverbindungen” (Ftorning organik birikmalarini osonlikcha tayyorlash usuli haqida) Yustus Libebigning Annalen der Chemie, 1886, 235-jild, p. 255-271; doi:10.1002 / jlac.18862350303
- ^ To'fon, D. T. (1933). "Ftorobenzol". Org. Sintez. 13: 46. doi:10.15227 / orgsyn.013.0046..
- ^ Rozental, Joel; Shuster, Devid I. (2003). "Elektrofil aromatik almashtirish va shunga o'xshash hodisalarda florobenzolning anomal reaktivligi". J. Chem. Ta'lim. 80 (6): 679. doi:10.1021 / ed080p679.
- ^ Sof suyuqliklarning Dielektrik doimiylari jadvali. Milliy standartlar byurosi. 1951 yil.
- ^ R.N. Perutz va T. Braun "O'tish davri metall-vositachiligi bilan bog'lanishni faollashtirish" Kengaytirilgan organometalik kimyo III, 2007, 1-jild, p. 725-758; doi:10.1016 / B0-08-045047-4 / 00028-5.