WikiDer > Kaliy sulfidi
 | |
| Ismlar | |
|---|---|
| IUPAC nomi Kaliy sulfidi | |
| Boshqa ismlar Dipotiy monosulfid, Dipotiy sulfidi, Kaliy monosulfid, Kaliy sulfidi | |
| Identifikatorlar | |
3D model (JSmol) | |
| ChemSpider | |
| ECHA ma'lumot kartasi | 100.013.816 |
| EC raqami |
|
PubChem CID | |
| RTECS raqami |
|
| UNII | |
| BMT raqami | 1847 1382 |
| |
| |
| Xususiyatlari | |
| K2S | |
| Molyar massa | 110.262 g / mol |
| Tashqi ko'rinish | toza: rangsiz nopok: sariq-jigarrang |
| Hidi | H2S |
| Zichlik | 1,74 g / sm3 |
| Erish nuqtasi | 840 ° C (1,540 ° F; 1,110 K) |
| Qaynatish nuqtasi | 912 ° C (1,674 ° F; 1,185 K) (parchalanadi) |
| KSH, KOH ga aylanadi | |
| Eriydiganlik boshqa erituvchilarda | ichida eriydi etanol, glitserol ichida erimaydi efir |
| −60.0·10−6 sm3/ mol | |
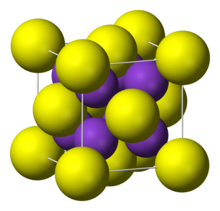
| Tuzilishi | |
| qarshiFlorit | |
| Xavf | |
| Asosiy xavf | Terining kuyishini keltirib chiqaradi. Atrof muhit uchun xavfli |
| GHS piktogrammalari |   |
| GHS signal so'zi | Xavfli |
| H314, H400 | |
| P260, P264, P273, P280, P301 + 330 + 331, P303 + 361 + 353, P304 + 340, P305 + 351 + 338, P310, P321, P363, P391, P405, P501 | |
| Tegishli birikmalar | |
Boshqalar kationlar | Natriy sulfidi, Temir (II) sulfid |
Tegishli birikmalar | Kaliy gidrosulfid, Kaliy sulfit, Kaliy sulfat |
Boshqacha ko'rsatilmagan hollar bundan mustasno, ulardagi materiallar uchun ma'lumotlar keltirilgan standart holat (25 ° C [77 ° F], 100 kPa da). | |
| Infobox ma'lumotnomalari | |
Kaliy sulfidi bo'ladi noorganik birikma formula bilan K2S. Rangsiz qattiq moddaga kamdan-kam uchraydi, chunki u suv bilan tezda reaksiyaga kirishadi, bu reaktsiya beradi kaliy gidrosulfid (KSH) va kaliy gidroksidi (KOH). Odatda, kaliy sulfidi atamasi suvsiz qattiq moddaga emas, balki bu aralashga nisbatan keng qo'llaniladi.
Tuzilishi
U "antiflorit tuzilishini" qabul qiladi, ya'ni kichik K+ ionlari tetraedralni egallaydi (F−) saytlar floritva kattaroq S2− markazlar sakkiz koordinatali maydonlarni egallaydi. Li2S, Na2Sva Rb2S xuddi shunday kristallanadi.[1]
Sintez va reaktsiyalar
U tomonidan ishlab chiqarilishi mumkin isitish K2SO4 uglerod bilan (koks):
- K2SO4 + 4 C → K2S + 4 CO
Laboratoriyada toza K2S suvsiz ammiakdagi kaliy va oltingugurt reaktsiyasi bilan tayyorlanishi mumkin. [2]
Sulfid juda asosli, natijada K2S to'liq va qaytarilmas gidrolizlar quyidagi tenglama bo'yicha suvda:
- K2S + H2O → KOH + KSH
Ko'p maqsadlar uchun bu reaktsiya SH aralashmasidan beri ahamiyatsiz− va OH− S ning manbai sifatida o'zini tutadi2−. Boshqa gidroksidi metall sulfidlari ham xuddi shunday yo'l tutishadi.[1]
Fişeklerde foydalaning
Kaliy sulfidlar qachon hosil bo'ladi qora kukun yondirilgan va ko'plab pirotexnik ta'sirlarda muhim vositalar hisoblanadi senko hanabi va ba'zilari yaltiroq formulalar.[3]
Shuningdek qarang
Adabiyotlar
- ^ a b Xolman, A. F.; Wiberg, E. "Anorganik kimyo" Akademik matbuot: San-Diego, 2001 y. ISBN 0-12-352651-5.
- ^ Preparat noorganik kimyo bo'yicha qo'llanma, 2-nashr. G. Brauer tomonidan tahrirlangan, Academic Press, 1963, NY. Vol. 1. p. 360.
- ^ Shimizu, Takeo. "Fireworks: san'at, fan va texnika". Pirotexnika nashrlari: Ostin, 1981. ISBN 0-929388-05-4.