WikiDer > Rubidiy karbonat
 | |
| Ismlar | |
|---|---|
| IUPAC nomi Rubidiy karbonat | |
| Identifikatorlar | |
3D model (JSmol) | |
| ChemSpider | |
| ECHA ma'lumot kartasi | 100.008.666 |
PubChem CID | |
| RTECS raqami |
|
CompTox boshqaruv paneli (EPA) | |
| |
| |
| Xususiyatlari | |
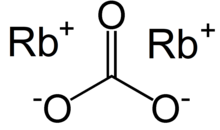
| Rb2CO3 | |
| Molyar massa | 230,945 g / mol |
| Tashqi ko'rinish | Oq kukun, juda gigroskopik |
| Erish nuqtasi | 837 ° C (1,539 ° F; 1,110 K)[1] |
| Qaynatish nuqtasi | 900 ° C (1,650 ° F; 1,170 K) (parchalanadi) |
| Juda eriydi | |
| −75.4·10−6 sm3/ mol | |
| Xavf | |
| Asosiy xavf | Irritant |
| o't olish nuqtasi | Yonuvchan emas |
| Tegishli birikmalar | |
Boshqalar kationlar | Lityum karbonat Natriy karbonat Kaliy karbonat Seziy karbonat |
Boshqacha ko'rsatilmagan hollar bundan mustasno, ulardagi materiallar uchun ma'lumotlar berilgan standart holat (25 ° C [77 ° F], 100 kPa da). | |
| Infobox ma'lumotnomalari | |
Rubidiy karbonat, Rb2CO3, ning qulay birikmasi rubidium; u barqaror, ayniqsa reaktiv emas va suvda oson eriydi va odatda rubidiy sotiladigan shakl.
Tayyorgarlik
Uni qo'shib tayyorlash mumkin ammoniy karbonat ga rubidiy gidroksidi.[2]
Foydalanadi
U barqarorlik va chidamlilikni oshirish hamda uning o'tkazuvchanligini kamaytirish orqali shisha ishlab chiqarishning ayrim turlarida qo'llaniladi. Bundan tashqari, ozuqa gazidan qisqa zanjirli spirtlarni tayyorlash uchun katalizatorning bir qismi sifatida ishlatiladi.[3]
Adabiyotlar
- ^ Pradyot Patnaik. Anorganik kimyoviy moddalar bo'yicha qo'llanma. McGraw-Hill, 2002 yil, ISBN 0-07-049439-8
- ^ Chisholm, Xyu, nashr. (1911). . Britannica entsiklopediyasi. 23 (11-nashr). Kembrij universiteti matbuoti. p. 809.
- ^ Kanada patentlari
| Bu noorganik birikma- tegishli maqola a naycha. Siz Vikipediyaga yordam berishingiz mumkin uni kengaytirish. |