WikiDer > Lityum amid
 | |
 | |
| Ismlar | |
|---|---|
| IUPAC nomi Lityum amid | |
| Boshqa ismlar Litamid | |
| Identifikatorlar | |
3D model (JSmol) | |
| ChemSpider | |
| ECHA ma'lumot kartasi | 100.029.062 |
PubChem CID | |
| UNII | |
CompTox boshqaruv paneli (EPA) | |
| |
| |
| Xususiyatlari | |
| LiNH 2 | |
| Molyar massa | 22,96 g / mol |
| Tashqi ko'rinishi | oq qattiq |
| Zichlik | 1,178 g / sm3 |
| Erish nuqtasi | 375 ° C (707 ° F; 648 K) |
| Qaynatish nuqtasi | 430 ° C (806 ° F; 703 K) parchalanadi |
| reaksiyaga kirishadi | |
| Eriydiganlik | ichida ozgina eriydi etanol ichida erimaydi ammiak |
| Termokimyo | |
Std entalpiyasi shakllanish (ΔfH⦵298) | -182 kJ / mol |
| Xavf | |
| NFPA 704 (olov olmos) | |
Boshqacha ko'rsatilmagan hollar bundan mustasno, ulardagi materiallar uchun ma'lumotlar keltirilgan standart holat (25 ° C [77 ° F], 100 kPa da). | |
| Infobox ma'lumotnomalari | |
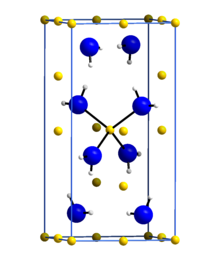
Lityum amid yoki lityum azanid bu noorganik birikma LiNH kimyoviy formulasi bilan2. Bu tetragonal kristalli tuzilishga ega oq tanadir. Lityum amidni davolash orqali olish mumkin lityum suyuqlik bilan metall ammiak:[1]
- 2Li + 2NH3 → 2LiNH2 + H2
Boshqa lityum amidlar
Ominlarning konjugat asoslari amidlar sifatida tanilgan. Shunday qilib, a lityum amid l ning lityum tuzi sinfidagi har qanday birikmani ham nazarda tutishi mumkin omin. Ushbu birikmalar Li
- 2Li + 2R2NH → 2LiNR2 + H2
Lityum amidlar juda reaktiv birikmalardir. Xususan, ular kuchli asoslar.
Misollar
Lityum tetrametilpiperidid tetramer sifatida kristallangan.[2] Boshqa tomondan, trimer sifatida bis (1-feniletil) amin kristalizatsiyasining lityum hosilasi:[3]
Bundan tashqari, metalldan aralash oligomerlarni tayyorlash mumkin alkoksidlar va amidlar.[4] Ular bilan bog'liq super bazalar bu metall alkoksidlar va alkillarning aralashmalari. Siklik oligomerlar amidning azoti a hosil bo'lganda hosil bo'ladi sigma aloqasi litiyga, azot esa yolg'iz juftlik boshqa metall markaz bilan bog'lanadi.
Boshqa organolitiy birikmalari (masalan BuLi) odatda yuqori tartibli, birlashtirilgan turlarda mavjud va ular orqali ishlaydi deb hisoblanadi.
Shuningdek qarang
Adabiyotlar
- ^ P. V. Schenk (1963). "Lityum amid". G. Brauerda (tahrir). Preparat noorganik kimyo bo'yicha qo'llanma, 2-nashr. 1. NY, NY: Academic Press. p. 454.
- ^ M.F. Lappert; M.J.Sleyd; A. Singx; J.L.Etvud; R.D.Rojers; R. Shokir (1983). "Steril ravishda to'sqinlik qiladigan lityum amidlar va ularning dietil efirlarining tuzilishi va reaktivligi: [Li {N (SiMe) ning kristalli va molekulyar tuzilmalari3)2} (OEt2)]2 va tetrakis (2,2,6,6-tetramethylpiperidinatolithium) ". Amerika Kimyo Jamiyati jurnali. 105 (2): 302–304. doi:10.1021 / ja00340a031.
- ^ D.R. Armstrong; K.V. Xenderson; A.R. Kennedi; VJ Kerr; F.S. Mair; J.H. Moir; P.H. Moran; R. Snayt (1999). "Chiral lityum amidlarning strukturaviy tadqiqotlari [{PhC (H) Me}"2NLi] va [PhCH2A-metilbenzilamindan olingan {PhC (H) Me} NLi · THF] ". Dalton operatsiyalari: 4063–4068. doi:10.1039 / A904725E.
- ^ K.V. Xenderson, D.S. Uolter va P.G. Villiard (1995). "Unimetal asoslar majmuasini aniqlash 6Li NMR spektroskopiyasi va bitta kristalli analiz ». Amerika Kimyo Jamiyati jurnali. 117 (33): 8680–8681. doi:10.1021 / ja00138a030.
- Merck indeksi, 11-nashr, 5398.


